[ad_1]
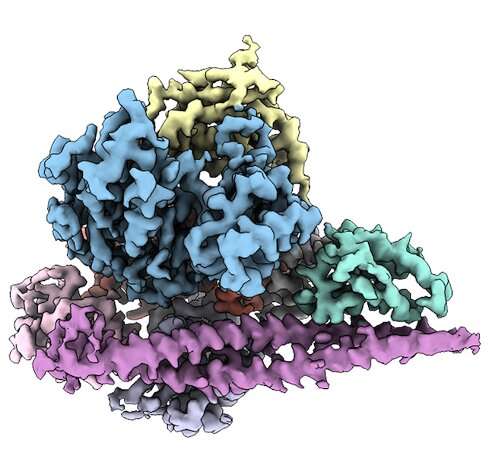
Определив трехмерную структуру PI3Kα (на фото), исследователи Скриппса проложили путь к лекарствам, нацеленным на белок в раковых клетках. Предоставлено: Исследование Скриппса.
Чтобы разработать лекарства, которые останавливают рост агрессивных видов рака, необходимо знать структуру белков, запускающих двигатели рака.
В серии из трех статей, опубликованных в Труды Национальной академии наук, Ученые Scripps Research осветили трехмерную структуру фосфоинозитид-3-киназы альфа (PI3Kα), белка, который часто мутирует в раковых клетках. Более того, исследовательская группа пролила свет на то, как эта структура меняется при мутациях, связанных с раком, прокладывая путь к лекарствам, которые могут воздействовать только на мутировавшие версии.
«Мы надеемся, что эти подробные структурные данные приведут к открытию лекарств, которые воздействуют на раковые клетки, но не на здоровые клетки», — говорит старший автор Питер Фогт, доктор философии, профессор кафедры молекулярной медицины Scripps Research. «Это потенциально может устранить побочные эффекты, связанные с текущими препаратами PI3Kα».
PI3Kα играет центральную роль в выживании и росте клеток. В здоровых клетках белок включается и выключается по мере необходимости. Но при многих типах рака, включая рак молочной железы, колоректальный рак, рак эндометрия и головного мозга, мутации в PI3Kα постоянно делают его активным, способствуя неконтролируемому росту опухолей.
Современные лекарства, которые нацелены на то, чтобы затормозить PI3Kα, связываются с участком белка, который редко меняется между здоровой и мутированной версиями; это означает, что все PI3Kα в организме отключены. Из-за этого эти ингибиторы PI3Kα имеют длинный список побочных эффектов и токсичности.
«Чтобы решить эту проблему, вам нужно создать ингибиторы, которые распознают только мутировавшие версии PI3Kα», — говорит Фогт. «Но для этого вам нужна структурная информация о том, что отличает мутировавший, сверхактивный PI3Kα от нормального PI3Kα».
Это непростая задача: PI3Kα является особенно гибким, «волнистым» белком, поэтому сложно получить единый снимок его структуры. Группа Vogt, однако, обнаружила, что когда PI3Kα связывается с одним из существующих ингибиторов, он становится более стабильным.
В ПНАС статьи, опубликованные в ноябре 2021 г. и сентябре 2022 г., они использовали тип метода визуализации, известный как криогенная электронная микроскопия (крио-ЭМ), для разработки трехмерной структуры PI3Kα. Зная это, они сначала изучили структуру PI3Kα, связанную с ингибитором. Затем, чтобы визуализировать белок без ингибитора, они использовали сшивающие молекулы для прикрепления различных частей PI3Kα к самой себе, стабилизируя наиболее гибкие части белка.
Совсем недавно исследовательская группа использовала тот же набор крио-ЭМ инструментов, чтобы собрать воедино структуру двух мутировавших версий PI3Kα, часто обнаруживаемых в раковых клетках. Эта работа, опубликованная в прошлом месяце в ПНАСпоказали, как некоторые сегменты мутантного PI3Kα напоминают активированную форму PI3Kα.
«Происходят довольно серьезные структурные изменения, — говорит Фогт. «И, в конце концов, изменения, по сути, имитируют нормальную активированную форму белка, с той лишь разницей, что он всегда находится в этой активной структуре».
Полученные данные указывают на способы использования лекарств для отключения этой постоянно включенной версии PI3Kα в раковых клетках без отключения здоровой PI3Kα. Ключевым моментом, по словам Фогта, является то, что лекарства должны будут связываться с другой частью белка PI3Kα, отличной от той, с которой связываются существующие ингибиторы PI3Kα — частью, которая структурно различается между здоровой и мутированной версиями белка.
Его лабораторная группа продолжает это исследование, проводя дополнительные исследования, показывающие, как современные лекарства изменяют структуру PI3Kα.
Дополнительная информация:
Xiao Liu et al, Крио-ЭМ структуры раковых специфичных спиральных и киназных доменных мутаций PI3Kα, Труды Национальной академии наук (2022). DOI: 10.1073/pnas.2215621119
Предоставлено Исследовательским институтом Скриппса.
Цитата: Структурные исследования предлагают практическое руководство по разработке лекарств от рака (9 декабря 2022 г.), полученное 9 декабря 2022 г. с https://phys.org/news/2022-12-how-to-cancer-drugs.html.
Этот документ защищен авторским правом. За исключением любой честной сделки с целью частного изучения или исследования, никакая часть не может быть воспроизведена без письменного разрешения. Контент предоставляется только в ознакомительных целях.
[ad_2]
Source link
